Pengertian :
Larutan
penyangga, larutan dapar, atau buffer adalah larutan yang digunakan
untuk mempertahankan nilai pH tertentu agar tidak banyak berubah selama
reaksi kimia berlangsung. Sifat yang khas dari larutan penyangga ini
adalah pH-nya hanya berubah sedikit dengan pemberian sedikit asam kuat
atau basa kuat.
Larutan
penyangga tersusun dari asam lemah dengan basa konjugatnya atau oleh
basa lemah dengan asam konjugatnya. Reaksi di antara kedua komponen
penyusun ini disebut sebagai reaksi asam-basa konjugasi.
Komponen Larutan Penyangga
Secara umum, larutan penyangga digambarkan sebagai campuran yang terdiri dari:
- Asam lemah (HA) dan basa konjugasinya (ion A-), campuran ini menghasilkan larutan bersifat asam.
- Basa lemah (B) dan asam konjugasinya (BH+), campuran ini menghasilkan larutan bersifat basa.
Komponen larutan penyangga terbagi menjadi:
a) Larutan penyangga yang bersifat asam
Larutan
ini mempertahankan pH pada daerah asam (pH < 7). Untuk mendapatkan
larutan ini dapat dibuat dari asam lemah dan garamnya yang merupakan
basa konjugasi dari asamnya. Adapun cara lainnya yaitu mencampurkan
suatu asam lemah dengan suatu basa kuat dimana asam lemahnya dicampurkan
dalam jumlah berlebih. Campuran akan menghasilkan garam yang mengandung
basa konjugasi dari asam lemah yang bersangkutan. Pada umumnya basa
kuat yang digunakan seperti natriumNa), kalium, barium, kalsium, dan
lain-lain.
b) Larutan penyangga yang bersifat basa
Larutan
ini mempertahankan pH pada daerah basa (pH > 7). Untuk mendapatkan
larutan ini dapat dibuat dari basa lemah dan garam, yang garamnya
berasal dari asam kuat. Adapun cara lainnya yaitu dengan mencampurkan
suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan
berlebih.
Cara kerja larutan penyangga
Larutan
penyangga mengandung komponen asam dan basa dengan asam dan basa
konjugasinya, sehingga dapat mengikatbaik ion H+ maupun ion OH-.
Sehingga penambahan sedikit asam kuat atau basa kuat tidak mengubah
pH-nya secara signifikan. Berikut ini cara kerja larutan penyangga:
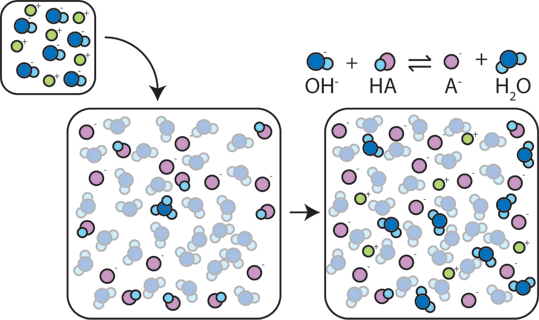
Larutan penyangga asam
Adapun
cara kerjanya dapat dilihat pada larutan penyangga yang mengandung
CH3COOH dan CH3COO- yang mengalami kesetimbangan. Dengan proses sebagai
berikut:
Pada penambahan asam
Penambahan
asam (H+) akan menggeser kesetimbangan ke kiri. Dimana ion H+ yang
ditambahkan akan bereaksi dengan ion CH3COO- membentuk molekul CH3COOH.
CH3COO-(aq) + H+(aq) → CH3COOH(aq)
Pada penambahan basa
Jika
yang ditambahkan adalah suatu basa, maka ion OH- dari basa itu akan
bereaksi dengan ion H+ membentuk air. Hal ini akan menyebabkan
kesetimbangan bergeser ke kanan sehingga konsentrasi ion H+ dapat
dipertahankan. Jadi, penambahan basa menyebabkan berkurangnya komponen
asam (CH3COOH), bukan ion H+. Basa yang ditambahkan tersebut bereaksi
dengan asam CH3COOH membentuk ion CH3COO- dan air.
CH3COOH(aq) + OH-(aq) → CH3COO-(aq) + H2O(l)
Larutan penyangga basa
Adapun
cara kerjanya dapat dilihat pada larutan penyangga yang mengandung NH3
dan NH4+ yang mengalami kesetimbangan. Dengan proses sebagai berikut:
Pada penambahan asam
Jika
ditambahkan suatu asam, maka ion H+ dari asam akan mengikat ion OH-.
Hal tersebut menyebabkan kesetimbangan bergeser ke kanan, sehingga
konsentrasi ion OH- dapat dipertahankan. Disamping itu penambahan ini
menyebabkan berkurangnya komponen basa (NH3), bukannya ion OH-. Asam
yang ditambahkan bereaksi dengan basa NH3 membentuk ion NH4+.
NH3 (aq) + H+(aq) → NH4+ (aq)
Pada penambahan basa
Jika
yang ditambahkan adalah suatu basa, maka kesetimbangan bergeser ke
kiri, sehingga konsentrasi ion OH- dapat dipertahankan. Basa yang
ditambahkan itu bereaksi dengan komponen asam (NH4+), membentuk komponen
basa (NH3) dan air.
NH4+ (aq) + OH-(aq) → NH3 (aq) + H2O(l)
Perhitungan pH Larutan Penyangga
Larutan penyangga asam
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[H+] = Ka x a/valxg
atau
pH = p Ka - log a/g
dengan, Ka = tetapan ionisasi asam lemah
a = jumlah mol asam lemah
g = jumlah mol basa konjugasi
Larutan penyangga basa
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[OH-] = Kb x b/valxg
atau
pH = p Kb - log b/g
dengan, Kb = tetapan ionisasi basa lemah
b = jumlah mol basa lemah
g = jumlah mol asam konjugasi
Fungsi Larutan Penyangga
Adanya
larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari
seperti pada obat-obatan, fotografi, industri kulit dan zat warna.
Selain aplikasi tersebut, terdapat fungsi penerapan konsep larutan
penyangga ini dalam tubuh manusia seperti pada cairan tubuh. Cairan
tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana
sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan
HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem
penyangga tersebut, dapat menjaga pH darah yang hampir konstan yaitu
sekitar 7,4. Selain itu penerapan larutan penyangga ini dapat kita temui
dalam kehidupan sehari-hari seperti pada obat tetes mata. Pada obat
tetes mata mempunyai pH yang sama dengan cairan tubuh kita, agar tidak
menimbulkan efek samping.
Fungsi Larutan Penyangga
Larutan
penyangga sangat penting dalam kehidupan; misalnya dalam analisis
kimia, biokimia, bakteriologi, zat warna, fotografi, dan industri kulit.
Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses
yang sangat sensitif terhadap perubahan pH. Darah dalam tubuh manusia
mempunyai kisaran pH 7,35 sampai 7,45, dan apabila pH darah manusia di
atas 7,8 akan menyebabkan organ tubuh manusia dapat rusak, sehingga
harus dijaga kisaran pHnya dengan larutan penyangga.
Darah Sebagai Larutan Penyangga
Ada
beberapa faktor yang terlibat dalam pengendalian pH darah, diantaranya
penyangga karbonat, penyangga hemoglobin dan penyangga fosfat.
a. Penyangga Karbonat
Penyangga karbonat berasal dari campuran asam karbonat (H 2 CO 3 ) dengan basa konjugasi bikarbonat (HCO 3 ).
H 2 CO 3 (aq) --> HCO 3(aq) + H + (aq)
Penyangga
karbonat sangat berperan penting dalam mengontrol pH darah. Pelari
maraton dapat mengalami kondisi asidosis, yaitu penurunan pH darah yang
disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi
ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit
jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang
mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu
peningkatan pH darah. Kadar oksigen yang sedikit di gunung dapat membuat
para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang
dilepas terlalu banyak, padahal CO 2 dapat larut dalam air menghasilkan H
2 CO 3 . Hal ini mengakibatkan pH darah akan naik. Kondisi alkalosis
dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan,
kadang-kadang karena cemas dan histeris).
b. Penyangga Hemoglobin
Pada
darah, terdapat hemoglobin yang dapat mengikat oksigen untuk
selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari
larutan penyangga oksi hemoglobin adalah:
HHb + O 2 (g) « HbO 2 - + H +
Asam hemoglobin ion aksi hemoglobin
Keberadaan
oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +,
sehingga pH darah juga dipengaruhi olehnya. Pada reaksi di atas O 2
bersifat basa. Hemoglobin yang telah melepaskan O 2 dapat mengikat H +
dan membentuk asam hemoglobin. Sehingga ion H + yang dilepaskan pada
peruraian H 2 CO 3 merupakan asam yang diproduksi oleh CO 2 yang
terlarut dalam air saat metabolisme.
c. Penyangga Fosfat
Pada
cairan intra sel, kehadiran penyangga fosfat sangat penting dalam
mengatur pH darah. Penyangga ini berasal dari campuran dihidrogen fosfat
(H 2 PO 4 - ) dengan monohidrogen fosfat (HPO 3 2- ).
H 2 PO 4 - (aq) + H + (aq) --> H 2 PO 4(aq)
H 2 PO 4 - (aq) + OH - (aq) --> HPO 4 2- (aq) ) + H 2 O (aq)
Penyangga
fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel hanya
sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin.
Fungsi Larutan Penyangga
1.
Fungsi pertama: Adanya larutan buffer ini dapat kita lihat dalam
kehidupan sehari-hari seperti pada obat-obatan, fotografi, industri
kulit dan zat warna. Selain aplikasi tersebut, terdapat Fungsi penerapan
konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan
tubuh.
2.
Fungsi Buffer dalam kehidupan sehari-hari – Cairan tubuh ini bisa dalam
cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama
dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi
dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat
menjaga pH darah yang hampir konstan yaitu sekitar 7,4.
3.
Menjaga pH pada plasma darah agar berada pada pH berkisar 7,35 – 7,45
,yaitu dari ion HCO3- denganion Na+. Apabila pH darah lebih dari 7,45
akan mengalami alkalosis, akibatnya terjadi hiperventilasi / bernapas
berlebihan, mutah hebat. Apabila pH darah kurang dari 7,35 akan
mengalami acidosis akibatnya jantung ,ginjal ,hati dan pencernaan akan
terganggu.
4.
Menjaga pH cairan tubuh agar ekskresi ion H+ pada ginjal tidak
terganggu, yaitu asam dihidrogen posphat (H2PO4-) dengan basa
monohidrogen posphat (HPO4-2)
5.
Fungsi buffer – Menjaga pH makanan olahan dalam kaleng agar tidak mudah
rusak /teroksidasi (asam benzoat dengan natrium benzoat).
6. Selain itu penerapan larutan buffer ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata.
Kamis, 01 Mei 2014
Langganan:
Posting Komentar (Atom)
0 komentar:
Posting Komentar